PRP moderno: "PRP clínico"
Nos últimos 10 anos, o esquema de tratamento do PRP sufriu grandes cambios.A través da investigación experimental e clínica, agora temos unha mellor comprensión da fisioloxía das plaquetas e doutras células.Ademais, varias avaliacións sistemáticas de alta calidade, metaanálises e ensaios controlados aleatorios demostraron a eficacia da biotecnoloxía PRP en moitos campos médicos, incluíndo dermatoloxía, cirurxía cardíaca, cirurxía plástica, cirurxía ortopédica, xestión da dor, enfermidades da columna vertebral e medicina deportiva. .
A característica actual do PRP é a súa concentración plaquetaria absoluta, que cambia desde a definición inicial de PRP (incluíndo a concentración plaquetaria superior ao valor inicial) a máis de 1 × 10 6/µ L ou unhas 5 veces a concentración plaquetaria mínima en plaquetas de liña de base.Na extensa revisión de Fadadu et al.Avaliáronse 33 sistemas e protocolos PRP.O reconto de plaquetas da preparación final de PRP producida por algúns destes sistemas é menor que o do sangue enteiro.Informaron de que o factor plaquetario do PRP aumentou tan baixo como 0,52 co kit de spin simple (Selphyl®).En cambio, EmCyte Genesis PurePRPII ® de dobre rotación A concentración de plaquetas producida polo dispositivo é a máis alta (1,6 × 10 6 /µL).
Obviamente, os métodos in vitro e animais non son o ambiente de investigación ideal para unha transformación exitosa na práctica clínica.Do mesmo xeito, o estudo comparativo de dispositivos non apoia a decisión, porque mostran que a concentración de plaquetas entre os dispositivos PRP é moi diferente.Afortunadamente, a través da tecnoloxía e análise baseadas na proteómica, podemos aumentar a nosa comprensión das funcións celulares do PRP que afectan aos resultados do tratamento.Antes de chegar a un consenso sobre as preparacións e formulacións estandarizadas de PRP, o PRP debe seguir as formulacións clínicas de PRP para promover mecanismos substanciais de reparación dos tecidos e resultados clínicos progresivos.
Fórmula clínica de PRP
Na actualidade, o PRP clínico efectivo (C-PRP) caracterizouse como unha composición complexa de compoñentes pluricelulares autólogos en plasma de pequeno volume obtido dunha parte do sangue periférico despois da centrifugación.Despois da centrifugación, o PRP e os seus compoñentes celulares non plaquetarios poden ser recuperados do dispositivo de concentración segundo diferentes densidades celulares (das cales a densidade plaquetaria é a máis baixa).
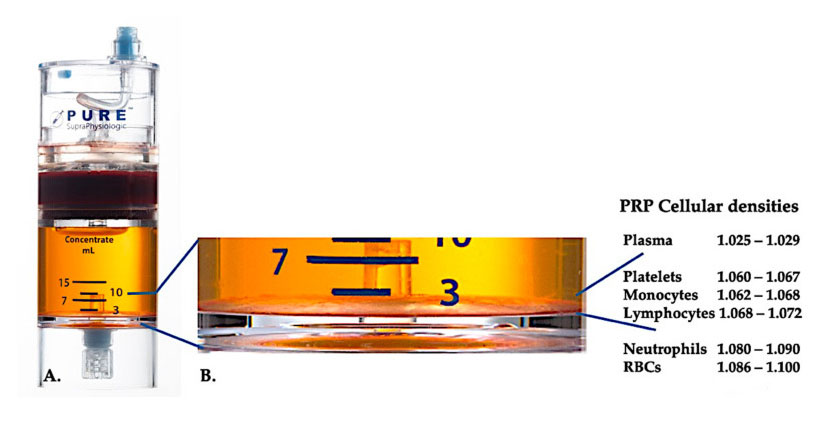
Use o equipo de separación de densidade celular PurePRP-SP ® (EmCyte Corporation, Fort Myers, FL, EUA) para sangue enteiro despois de dous procedementos de centrifugación.Despois do primeiro proceso de centrifugación, o compoñente sanguíneo enteiro separouse en dúas capas básicas, a suspensión plasmática de plaquetas (magra) e a capa de glóbulos vermellos.En A, o segundo paso de centrifugación completouse.O volume real de PRP pódese extraer para a aplicación do paciente.O aumento en B mostra que existe unha capa marrón de sedimentación eritrocitaria multicompoñente organizada (representada por unha liña azul) na parte inferior do equipo, que contén altas concentracións de plaquetas, monocitos e linfocitos, en función do gradiente de densidade.Neste exemplo, segundo o protocolo de preparación C-PRP con neutrófilos pobres, extraerase a porcentaxe mínima de neutrófilos (<0,3%) e eritrocitos (<0,1%).
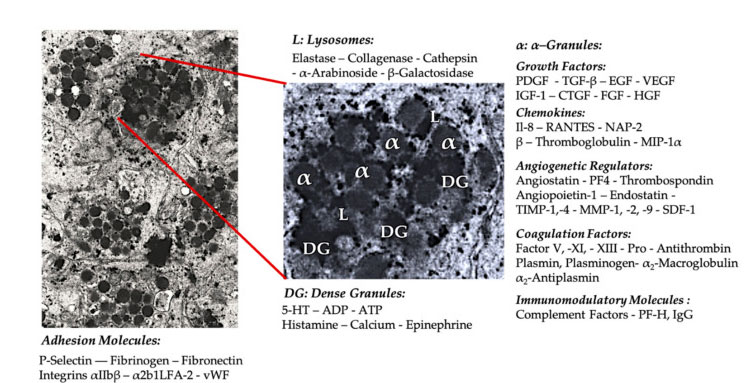
Gránulo plaquetario
Na aplicación clínica inicial de PRP, os gránulos α son a estrutura interna plaquetaria máis citada, porque conteñen factores de coagulación, un gran número de PDGF e reguladores anxioxénicos, pero teñen pouca función tromboxénica.Outros factores inclúen compoñentes de quimiocinas e citocinas menos coñecidos, como o factor plaquetario 4 (PF4), a proteína básica preplaquetaria, a P-selectina (un activador da integrina) e a quimiocina RANTES (regulada pola activación, que expresa células T normais e presumiblemente). segregando).A función xeral destes compoñentes específicos do gránulo plaquetario é captar e activar outras células inmunitarias ou inducir a inflamación das células endoteliais.
Os compoñentes granulares densos como ADP, serotonina, polifosfato, histamina e adrenalina úsanse máis implícitamente como reguladores da activación plaquetaria e da trombose.O máis importante é que moitos destes elementos teñen a función de modificar as células inmunitarias.O ADP plaquetario é recoñecido polo receptor P2Y12ADP nas células dendríticas (DC), aumentando así a endocitose do antíxeno.A DC (célula presentadora de antíxenos) é moi importante para iniciar a resposta inmune das células T e controlar a resposta inmune protectora, que une o sistema inmunitario innato e o sistema inmunitario adaptativo.Ademais, o trifosfato de adenosina plaquetario (ATP) envía sinais a través do receptor de células T P2X7, o que leva a unha maior diferenciación das células T auxiliares CD4 en células T auxiliares 17 (Th17) proinflamatorias.Outros compoñentes de gránulos densos plaquetarios (como o glutamato e a serotonina) inducen a migración dos linfocitos T e aumentan a diferenciación de monocitos a DC, respectivamente.No PRP, estes inmunomoduladores derivados de partículas densas están moi enriquecidos e teñen funcións inmunes substanciais.
O número de interaccións potenciais directas e indirectas entre as plaquetas e outras células (receptoras) é amplo.Polo tanto, a aplicación de PRP no ambiente local do tecido patolóxico pode inducir unha variedade de efectos inflamatorios.
Concentración plaquetaria
C-PRP debe conter doses clínicas de plaquetas concentradas para producir efectos terapéuticos beneficiosos.As plaquetas en C-PRP deben estimular a proliferación celular, a síntese de factores mesenquimatosos e neurotróficos, promover a migración de células quimiotácticas e estimular a actividade inmunorreguladora, como se mostra na figura.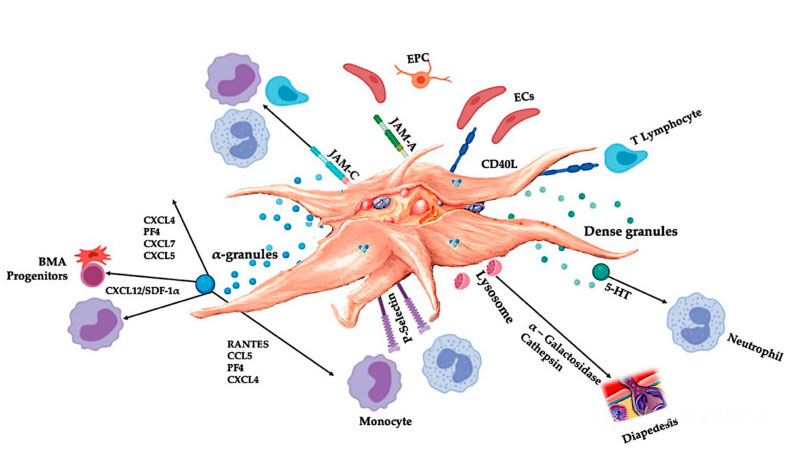
As plaquetas activadas, a liberación de PGF e as moléculas de adhesión median unha variedade de interaccións celulares: quimiotaxis, adhesión celular, migración e diferenciación celular, e regulan as actividades reguladoras inmunitarias.Estas interaccións plaqueta-célula contribúen á anxioxénese e á actividade inflamatoria e, finalmente, estimulan o proceso de reparación do tecido.Abreviaturas: BMA: aspirado de medula ósea, EPC: células proxenitoras endoteliais, EC: células endoteliais, 5-HT: 5-hidroxitriptamina, RANTES: regulación activada da expresión normal das células T e da secreción putativa, JAM: tipo de molécula de adhesión de unión, CD40L: cluster 40 ligando, SDF-1 α: factor-1 α derivado de células estromales, CXCL: ligando de quimiocinas (motivo CXC), PF4: factor plaquetario 4. Adaptado de Everts et al.
Marx foi a primeira persoa en demostrar que a cicatrización dos ósos e dos tecidos brandos mellorou, e que o reconto mínimo de plaquetas foi de 1 × 10 6 /µL. Estes resultados confirmáronse nun estudo de fusión lumbar a través do forame intervertebral, cando a dose de plaquetas era maior que 1,3 × A 106 plaquetas/µL, este estudo demostrou máis fusión.Ademais, Giusti et al.Revelado 1,5 × O mecanismo de reparación do tecido a unha dose de 109 require plaquetas/ml para inducir a anxioxénese funcional mediante a actividade das células endoteliais.Neste último estudo, as concentracións máis altas reduciron o potencial de anxioxénese das plaquetas dentro e arredor dos folículos.Ademais, os datos anteriores mostraron que a dose de PRP tamén afectaría os resultados do tratamento.Polo tanto, para inducir significativamente a reacción de anxioxénese e estimular a proliferación celular e a migración celular, o C-PRP debe conter polo menos 7,5 nunha botella de tratamento con PRP de 5 mL × 10 9 poden entregar plaquetas.
Ademais da dependencia da dose, o efecto do PRP sobre a actividade celular parece ser moi dependente do tempo.Sophie et al.Estes resultados suxiren que a exposición a curto prazo aos lisados de plaquetas humanas pode estimular a proliferación das células óseas e a quimiotaxis.Pola contra, a exposición a longo prazo ao PRP levará a niveis máis baixos de fosfatase alcalina e formación de minerais.
Glóbulo vermello
Os glóbulos vermellos son os encargados de transportar o osíxeno aos tecidos e transferir o dióxido de carbono dos tecidos aos pulmóns.Non teñen núcleo e están compostos por moléculas hemo que se unen a proteínas.Os compoñentes de ferro e hemo nos glóbulos vermellos promoven a combinación de osíxeno e dióxido de carbono.Xeralmente, o ciclo de vida dos glóbulos vermellos é duns 120 días.Son eliminados da circulación polos macrófagos mediante un proceso chamado envellecemento dos glóbulos rojos.Os glóbulos vermellos das mostras de PRP poden danarse en condicións de cizalla (por exemplo, cirurxía de hemorraxia enteira, proceso inmunolóxico, estrés oxidativo ou esquema de concentración de PRP inadecuado).Polo tanto, a membrana celular de RBC descomponse e libera hemoglobina tóxica (Hb), medida pola hemoglobina libre de plasma (PFH), hemo e ferro.O PFH e os seus produtos de degradación (hemo e ferro) conducen conxuntamente a efectos nocivos e citotóxicos nos tecidos, que provocan estrés oxidativo, perda de óxido nítrico, activación de vías inflamatorias e inmunosupresión.Estes efectos eventualmente provocarán unha disfunción da microcirculación, vasoconstricción local e lesións vasculares, así como graves danos nos tecidos.
O máis importante é que cando se envía ao tecido eritrocitos que conteñen C-PRP, provocará unha reacción local chamada eriptose, que provocará a liberación dun eficaz inhibidor da migración de citocinas e macrófagos.Esta citocina inhibe a migración de monocitos e macrófagos.Exerce fortes sinais proinflamatorios aos tecidos circundantes, inhibe a migración de células nai e a proliferación de fibroblastos e leva a unha importante disfunción celular local.Polo tanto, é importante limitar a contaminación de RBC nos preparados de PRP.Ademais, nunca se determinou o papel dos glóbulos vermellos na rexeneración dos tecidos.Un proceso adecuado de centrifugación e preparación de C-PRP adoita reducir ou mesmo eliminar a presenza de glóbulos vermellos, evitando así as consecuencias adversas da hemólise e da policitemia.
Leucocitos en C-PRP
A presenza de glóbulos brancos nos preparados de PRP depende do equipo de tratamento e do esquema de preparación.Nos equipos de PRP baseados en plasma, os glóbulos brancos son completamente eliminados;Non obstante, os glóbulos brancos concentráronse significativamente na preparación de PRP da capa marrón de sedimentación de eritrocitos.Debido aos seus mecanismos de defensa inmune e do hóspede, os glóbulos brancos afectan moito á bioloxía interna das condicións agudas e crónicas dos tecidos.Estas características serán discutidas máis abaixo.Polo tanto, a presenza de leucocitos específicos en C-PRP pode causar importantes efectos celulares e tisulares.Máis concretamente, diferentes sistemas de sedimentación de eritrocitos de capa marrón-amarela de PRP usan diferentes esquemas de preparación, producindo así diferentes proporcións de neutrófilos, linfocitos e monocitos no PRP.Os eosinófilos e os basófilos non se poden medir nas preparacións de PRP porque as súas membranas celulares son demasiado fráxiles para soportar forzas de procesamento centrífuga.
Neutrófilos
Os neutrófilos son leucocitos esenciais en moitas vías de curación.Estas vías combínanse coas proteínas antimicrobianas presentes nas plaquetas para formar unha densa barreira contra os patóxenos invasores.A existencia de neutrófilos determínase segundo o obxectivo de tratamento do C-PRP.Poden ser necesarios niveis aumentados de inflamación dos tecidos na bioterapia PRP para o coidado de feridas crónicas ou en aplicacións dirixidas ao crecemento ou a cicatrización dos ósos.É importante destacar que atopáronse funcións adicionais dos neutrófilos en varios modelos, facendo fincapé no seu papel na anxioxénese e na reparación dos tecidos.Non obstante, os neutrófilos tamén poden causar efectos nocivos, polo que non son axeitados para algunhas aplicacións.Zhou e Wang demostraron que o uso de PRP rico en neutrófilos pode levar a un aumento da proporción de coláxeno tipo III con coláxeno tipo I, exacerbando así a fibrose e reducindo a forza do tendón.Outras características nocivas mediadas polos neutrófilos son a liberación de citocinas inflamatorias e metaloproteinases da matriz (MMPs), que poden promover a inflamación e o catabolismo cando se aplican aos tecidos.
Leucomonocitos
No C-PRP, os linfocitos T e B mononucleares están máis concentrados que calquera outro glóbulo branco.Están estreitamente relacionados coa inmunidade adaptativa citotóxica mediada por células.Os linfocitos poden desencadear reaccións celulares para loitar contra a infección e adaptarse aos invasores.Ademais, as citocinas derivadas dos linfocitos T (interferón-γ [IFN-γ] e a interleucina-4 (IL-4) melloran a polarización dos macrófagos. Verassar et al. Está demostrado que os linfocitos T convencionais poden favorecer indirectamente a cicatrización dos tecidos nos o modelo de rato regulando a diferenciación de monocitos e macrófagos.
Monocito: célula reparadora multipotente
Segundo o dispositivo de preparación de PRP utilizado, os monocitos poden sobresaír ou non existir na botella de tratamento de PRP.Desafortunadamente, o seu rendemento e a súa capacidade de rexeneración raramente se comentan na literatura.Polo tanto, préstase pouca atención aos monocitos no método de preparación ou na fórmula final.O grupo dos monocitos é heteroxéneo, orixinado a partir de células proxenitoras da medula ósea e transportado aos tecidos periféricos a través da vía de células nai hematopoyéticas segundo a estimulación do microambiente.Durante a homeostase e a inflamación, os monocitos circulantes abandonan o torrente sanguíneo e son recrutados para os tecidos feridos ou degradados.Poden actuar como macrófagos (M Φ) Células efectoras ou células proxenitoras.Os monocitos, macrófagos e células dendríticas representan o sistema fagocítico mononuclear (MPS). Unha característica típica do MPS é a plasticidade do seu patrón de expresión xénica e a superposición funcional entre estes tipos celulares.Nos tecidos dexenerados, os macrófagos residentes, os factores de crecemento que actúan localmente, as citocinas proinflamatorias, as células apoptóticas ou necróticas e os produtos microbianos inician os monocitos a diferenciarse en grupos de células MPS.Supoñamos que cando se inxecta C-PRP que contén monocitos de alto rendemento no microambiente local da enfermidade, é probable que os monocitos se diferencien en M Φ para causar grandes cambios celulares.
De monocito a M Φ No proceso de transformación, fenotipo M Φ específico.Nos últimos dez anos desenvolveuse un modelo que integra M Φ O complexo mecanismo de activación descríbese como polarización de dous estados opostos: M Φ Fenotipo 1 (M Φ 1, Activación clásica) e M Φ Fenotipo 2 (M Φ). 2, activación alternativa).M Φ 1 caracterízase pola secreción de citocinas inflamatorias (IFN-γ) e óxido nítrico para producir un mecanismo eficaz de matar patóxenos.M Φ O fenotipo tamén produce factor de crecemento endotelial vascular (VEGF) e factor de crecemento de fibroblastos (FGF).M Φ O fenotipo está composto por células antiinflamatorias con alta fagocitose.M Φ 2 Produce compoñentes da matriz extracelular, anxioxénese e quimiocinas, e interleucina 10 (IL-10).Ademais da defensa dos patóxenos, M Φ Tamén pode reducir a inflamación e promover a reparación dos tecidos.Cabe destacar que M Φ 2 subdividiuse en M in vitro Φ 2a、M Φ 2b e M Φ 2. Depende do estímulo.A tradución in vivo destes subtipos é difícil porque o tecido pode conter grupos M Φ mesturados.Curiosamente, en función dos sinais ambientais locais e dos niveis de IL-4, pódese converter M Φ 1 proinflamatorio para promover a reparación M Φ 2。 A partir destes datos, é razoable supoñer que hai altas concentracións de monocitos e preparados de M Φ C-PRP. poden contribuír a unha mellor reparación dos tecidos porque teñen capacidades de reparación de tecidos antiinflamatorios e de transdución de sinais celulares.
Definición confusa da fracción de glóbulos brancos no PRP
A presenza de glóbulos brancos nos frascos de tratamento de PRP depende do dispositivo de preparación de PRP e pode ter diferenzas significativas.Hai moitas disputas sobre a existencia de leucocitos e a súa contribución a diferentes produtos sub-PRP (como PRGF, P-PRP, LP-PRP, LR-PRP, P-PRF e L-PRF) Nunha revisión recente, seis aleatorizados ensaios controlados (nivel de evidencia 1) e tres estudos comparativos prospectivos (nivel de evidencia 2) implicaron 1055 pacientes, o que indica que LR-PRP e LP-PRP tiñan unha seguridade similar.O autor concluíu que a reacción adversa do PRP pode non estar directamente relacionada coa concentración de glóbulos brancos.Noutro estudo, LR-PRP non cambiou a interleucina inflamatoria (IL-1) no xeonllo OA β、 IL-6, IL-8 e IL-17).Estes resultados apoian a opinión de que o papel dos leucocitos na actividade biolóxica do PRP in vivo pode vir da diafonía entre plaquetas e leucocitos.Esta interacción pode promover a biosíntese doutros factores (como o lipoxíxeno), que poden compensar ou promover a regresión da inflamación.Despois da liberación inicial de moléculas inflamatorias (ácido araquidónico, leucotrieno e prostaglandina), as plaquetas activadas liberan lipoxíxeno A4 para evitar a activación dos neutrófilos.É neste ambiente onde o fenotipo M Φ de M Φ 1 Cambia a M Φ 2。 Ademais, cada vez hai máis evidencias de que as células mononucleares circulantes poden diferenciarse nunha variedade de tipos de células non fagocíticas debido á súa pluripotencia.
O tipo de PRP afectará á cultura MSC.En comparación coas mostras de PRP ou PPP puros, o LR-PRP pode inducir unha proliferación significativamente maior de MSC derivadas da medula ósea (BMMSC), cunha liberación máis rápida e unha mellor actividade biolóxica do PGF.Todas estas características son propicias para engadir monocitos á botella de tratamento con PRP e recoñecer a súa capacidade inmunomoduladora e potencial de diferenciación.
Regulación inmune conxénita e adaptativa do PRP
A función fisiolóxica máis famosa das plaquetas é controlar o sangrado.Acumúlanse no lugar da lesión do tecido e nos vasos sanguíneos danados.Estes eventos son causados pola expresión de integrinas e selectinas que estimulan a adhesión e agregación plaquetaria.O endotelio danado agrava aínda máis este proceso, e o coláxeno exposto e outras proteínas da matriz subendotelial promoven a activación profunda das plaquetas.Nestes casos, comprobouse o importante papel da interacción entre o factor de von Willebrand (vWF) e a glicoproteína (GP), especialmente GP-Ib.Despois da activación plaquetaria, as plaquetas α-、 densas, os lisosomas e os gránulos T regulan a exocitose e liberan o seu contido ao medio extracelular.
Molécula de adhesión plaquetaria
Para comprender mellor o papel do PRP nos tecidos inflamatorios e as plaquetas na resposta inmune, debemos entender como os diferentes receptores da superficie plaquetaria (integrinas) e as moléculas de adhesión á unión (JAM) e as interaccións celulares poden iniciar procesos críticos na inmunidade innata e adaptativa.
As integrinas son moléculas de adhesión á superficie celular que se atopan en varios tipos celulares e que se expresan en grandes cantidades nas plaquetas.As integrinas inclúen a5b1, a6b1, a2b1 LFA-2, (GPIa/IIa) e aIIbb3 (GPIIb/IIIa).Normalmente, existen nun estado estático e de baixa afinidade.Despois da activación, cambian ao estado de alta afinidade de unión ao ligando.As integrinas teñen diferentes funcións nas plaquetas e participan na interacción das plaquetas con varios tipos de glóbulos brancos, células endoteliais e matriz extracelular.Ademais, o complexo GP-Ib-V-IX exprésase na membrana plaquetaria e é o principal receptor para a unión co von vWF.Esta interacción media o contacto inicial entre as plaquetas e as estruturas subendoteliais expostas.A integrina plaquetaria e o complexo GP están relacionados con diversos procesos inflamatorios e xogan un papel importante na formación do complexo plaqueta-leucocito.En concreto, a integrina aIIbb3 é necesaria para formar un complexo estable combinando o fibrinóxeno co receptor do antíxeno do macrófago 1 (Mac-1) nos neutrófilos.
As plaquetas, os neutrófilos e as células endoteliais vasculares expresan moléculas específicas de adhesión celular, chamadas selectina.En condicións inflamatorias, as plaquetas expresan P-selectina e neutrófilos L-selectina.Despois da activación plaquetaria, a P-selectina pode unirse ao ligando PSGL-1 que existe nos neutrófilos e monocitos.Ademais, a unión de PSGL-1 inicia a reacción en cascada de sinal intracelular, que activa os neutrófilos mediante a integrina de neutrófilos Mac-1 e o antíxeno 1 relacionado coa función dos linfocitos (LFA-1).A Mac-1 activada únese a GPIb ou GPIIb/IIIa nas plaquetas a través do fibrinóxeno, estabilizando así a interacción entre neutrófilos e plaquetas.Ademais, o LFA-1 activado pode combinarse coa molécula de adhesión intercelular plaquetaria 2 para estabilizar aínda máis o complexo neutrófilo-plaqueta para promover a adhesión a longo prazo coas células.
As plaquetas e os leucocitos xogan un papel fundamental nas respostas inmunitarias innatas e adaptativas
O corpo pode recoñecer corpos estraños e tecidos feridos en enfermidades agudas ou crónicas para iniciar a reacción en cascada de cicatrización de feridas e a vía inflamatoria.Os sistemas inmunitarios innatos e adaptativos protexen ao hóspede da infección, e os glóbulos brancos xogan un papel importante na superposición entre os dous sistemas.En concreto, os monocitos, os macrófagos, os neutrófilos e as células asasinas naturais xogan un papel fundamental no sistema innato, mentres que os linfocitos e os seus subconxuntos xogan un papel similar no sistema inmunitario adaptativo.
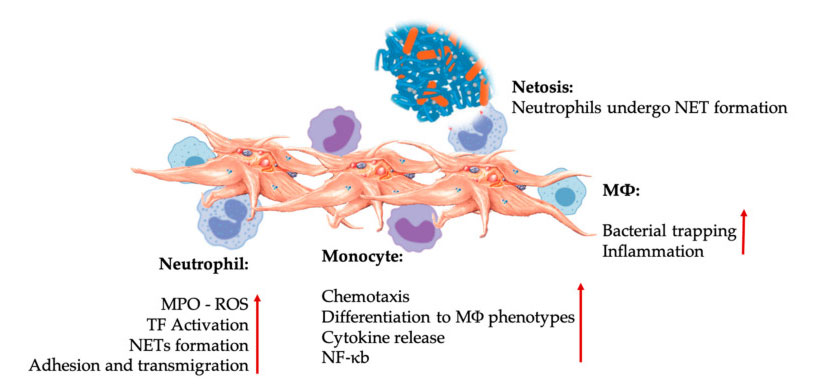
Interaccións plaquetarias e leucocitos nas interaccións das células inmunes innatas.As plaquetas interactúan con neutrófilos e monocitos, e finalmente con M Φ Interaccionan, axustan e aumentan as súas funcións efectoras.Estas interaccións plaqueta-leucocito conducen á inflamación a través de diferentes mecanismos, incluíndo a NETose.Abreviaturas: MPO: mieloperoxidase, ROS: especies reactivas do osíxeno, TF: factor tisular, NET: trampa extracelular de neutrófilos, NF- κ B: factor nuclear kappa B, M Φ: Macrófagos.
Sistema inmunitario innato
O papel do sistema inmunitario innato é identificar inespecíficamente microorganismos invasivos ou fragmentos de tecido e estimular a súa eliminación.Cando certas estruturas moleculares chamadas receptores de recoñecemento de patróns de expresión de superficie (PRR) se combinan con patróns moleculares relacionados con patóxenos e patróns moleculares relacionados co dano, activarase o sistema inmunitario innato.Hai moitos tipos de PRR, incluíndo o receptor tipo Toll (TLR) e o receptor tipo RIG-1 (RLR).Estes receptores poden activar o principal factor de transcrición kappa B (NF- κ B) Tamén regula múltiples aspectos da resposta inmune innata e adaptativa.Curiosamente, as plaquetas tamén expresan unha variedade de moléculas receptoras inmunorreguladoras na súa superficie e citoplasma, como a selectina P, o ligando CD40 da proteína transmembrana (CD40L), as citocinas (como a IL-1 β、 TGF-β) e o TLR específico das plaquetas. Polo tanto, as plaquetas poden interactuar con varias células inmunitarias.
Interacción plaqueta-glóbulo branco na inmunidade innata
Cando as plaquetas entran ou invaden o fluxo sanguíneo ou o tecido, as plaquetas son unha das células que detectan primeiro a lesión endotelial e os patóxenos microbianos.A agregación plaquetaria e promover a liberación de agonistas plaquetarios ADP, trombina e vWF, o que produce a activación plaquetaria e a expresión dos receptores de quimiocinas plaquetarias C, CC, CXC e CX3C, causando así plaquetas no sitio infectado ou lesións.
O sistema inmunitario innato está xeneticamente predeterminado para detectar invasores, como virus, bacterias, parasitos e toxinas, ou feridas e feridas dos tecidos.É un sistema inespecífico, porque calquera patóxeno identificarase como estranxeiro ou non propio e localizarase rapidamente.O sistema inmunitario innato depende dun conxunto de proteínas e fagocitos, que recoñecen as características ben conservadas dos patóxenos e activan rapidamente a resposta inmune para axudar a eliminar os invasores, aínda que o hóspede nunca estivo exposto a patóxenos específicos antes.
Os neutrófilos, os monocitos e as células dendríticas son as células inmunes innatas máis comúns no sangue.O seu recrutamento é necesario para unha resposta inmune precoz adecuada.Cando o PRP se usa na medicina rexenerativa, a interacción plaqueta-glóbulo branco regula a inflamación, a cicatrización de feridas e a reparación dos tecidos.O TLR-4 nas plaquetas estimula a interacción plaqueta-neutrófilo, que regula a chamada explosión oxidativa de leucocitos regulando a liberación de especies reactivas de osíxeno (ROS) e mieloperoxidase (MPO) dos neutrófilos.Ademais, a interacción entre a desgranulación plaquetas-neutrófilos e neutrófilos leva á formación de trampas neutrófilos-extracelulares (NETs).Os NET están compostos por núcleo de neutrófilos e outros contidos intracelulares de neutrófilos, que poden capturar bacterias e matalas mediante a NETose.A formación de NETs é un mecanismo esencial de eliminación dos neutrófilos.
Despois da activación plaquetaria, os monocitos poden migrar a tecidos enfermos e dexenerativos, onde realizan actividades de adhesión e segregan moléculas inflamatorias que poden cambiar a quimiotaxis e as propiedades proteolíticas.Ademais, as plaquetas poden inducir a activación dos monocitos NF-κ B para regular a función efectora dos monocitos, que é o mediador clave da resposta inflamatoria e da activación e diferenciación das células inmunes.As plaquetas promoven aínda máis a explosión oxidativa endóxena dos monocitos para promover a destrución dos patóxenos fagocíticos.A liberación de MPO está mediada pola interacción directa entre plaqueta-monocito CD40L-MAC-1.Curiosamente, cando a P-selectina activa as plaquetas en condicións inflamatorias agudas e crónicas do tecido, as quimiocinas derivadas das plaquetas PF4, RANTES, IL-1 β e CXCL-12 poden evitar a apoptose espontánea dos monocitos, pero favorecen a súa diferenciación en macrófagos.
Sistema inmunitario adaptativo
Despois de que o sistema inmunitario innato inespecífico recoñeza o dano microbiano ou tecido, o sistema inmunitario adaptativo específico asumirá o control.Os sistemas adaptativos inclúen linfocitos B de unión a antíxenos (células B) e linfocitos T convencionais (Treg) que coordinan a eliminación de patóxenos.As células T poden dividirse aproximadamente en células T auxiliares (células Th) e células T citotóxicas (células Tc, tamén coñecidas como células T asasinas).As células Th divídense ademais en células Th1, Th2 e Th17, que teñen funcións clave na inflamación.As células Th poden segregar citocinas proinflamatorias (por exemplo, IFN-γ, TNF-β) e varias interleucinas (por exemplo, IL-17). Son particularmente eficaces para previr a infección intracelular por virus e bacterias. As células Th estimulan a proliferación e diferenciación das células implicadas Resposta inmune. As células Tc son células efectoras, que poden eliminar microorganismos e células intracelulares e extracelulares.
Curiosamente, as células Th2 producen IL-4 e afectan polarización M Φ, M Φ Rexeneración guiada Fenotipo M Φ 2, mentres que IFN- γ M Φ Cambia ao fenotipo M Φ 1 inflamatorio, que depende da dose e do tempo das citocinas.Despois de activar a IL-4, M Φ 2 induce ás células Treg a diferenciarse en células Th2, e despois produce IL-4 adicional (bucle de retroalimentación positiva).As células Th converten M Φ O fenotipo diríxese ao fenotipo rexenerativo en resposta a axentes biolóxicos de orixe tisular.Este mecanismo baséase na evidencia de que as células Th xogan un papel importante no control da inflamación e na reparación dos tecidos.
Interacción plaqueta-glóbulo branco na inmunidade adaptativa
O sistema inmunitario adaptativo utiliza receptores específicos do antíxeno e lembra os patóxenos atopados anteriormente e destrúeos cando se atopa posteriormente co hóspede.Non obstante, estas respostas inmunitarias adaptativas desenvolvéronse lentamente.Konias et al.Mostra que o compoñente plaquetario contribúe á percepción do risco e á reparación dos tecidos, e que a interacción entre plaquetas e leucocitos promove a activación da resposta inmune adaptativa.
Durante a resposta inmune adaptativa, as plaquetas promoven as respostas de monocitos e macrófagos a través da maduración das células DC e NK, dando lugar a respostas específicas de células T e B.Polo tanto, os compoñentes do gránulo plaquetario afectan directamente a inmunidade adaptativa ao expresar CD40L, unha molécula que é esencial para regular a resposta inmune adaptativa.As plaquetas a través de CD40L non só xogan un papel na presentación do antíxeno, senón que tamén afectan a reacción das células T.Liu et al.Descubriuse que as plaquetas regulan a resposta das células T CD4 dun xeito complexo.Esta regulación diferencial dos subconxuntos de células T CD4 significa que as plaquetas promoven que as células T CD4 respondan aos estímulos inflamatorios, producindo así fortes respostas proinflamatorias e antiinflamatorias.
As plaquetas tamén regulan a resposta adaptativa mediada polas células B aos patóxenos microbianos.É ben sabido que CD40L nas células T CD4 activadas desencadeará o CD40 das células B, proporcionando o segundo sinal necesario para a activación dos linfocitos B dependentes das células T, a posterior conversión de alotipos e a diferenciación e proliferación de células B.En xeral, os resultados mostran claramente as distintas funcións das plaquetas na inmunidade adaptativa, o que indica que as plaquetas conectan a interacción entre os linfocitos T e os linfocitos B a través de CD40-CD40L, mellorando así a resposta das células B dependentes das células T.Ademais, as plaquetas son ricas en receptores de superficie celular, que poden promover a activación plaquetaria e liberar un gran número de moléculas activas inflamatorias e biolóxicas almacenadas en diferentes partículas plaquetarias, afectando así a resposta inmune innata e adaptativa.
Papel expandido da serotonina derivada das plaquetas no PRP
A serotonina (5-hidroxitriptamina, 5-HT) ten un claro papel clave no sistema nervioso central (SNC), incluíndo a tolerancia á dor.Estímase que a maior parte da 5-HT humana prodúcese no tracto gastrointestinal e despois a través da circulación sanguínea, onde é absorbida polas plaquetas a través do transportador de recaptación de serotonina e almacenada en partículas densas a alta concentración (65 mmol/L).O 5-HT é un coñecido neurotransmisor e hormona que axuda a regular varios procesos neuropsicolóxicos no SNC (5-HT central).Non obstante, a maior parte da 5-HT existe fóra do SNC (5-HT periférica) e está implicada na regulación das funcións biolóxicas sistémicas e celulares de múltiples sistemas de órganos, incluíndo sistemas cardiovascular, pulmonar, gastrointestinal, urogenital e funcional plaquetario.O 5-HT ten un metabolismo dependente da concentración nunha variedade de tipos celulares, incluíndo adipocitos, células epiteliais e glóbulos brancos.O 5-HT periférico tamén é un poderoso modulador inmune, que pode estimular ou inhibir a inflamación e afectar a varias células inmunitarias a través do seu receptor específico de 5-HT (5HTR).
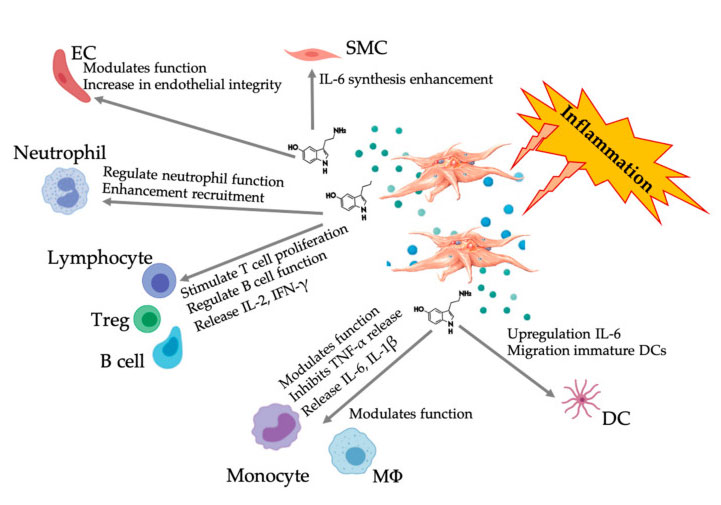
Mecanismo paracrino e autocrino da HT
A actividade da 5-HT está mediada pola súa interacción cos 5HTRs, que é unha superfamilia con sete membros (5-HT 1 – 7) e polo menos 14 subtipos de receptores diferentes, incluíndo o recentemente descuberto membro 5-HT 7, o seu membro periférico e función na xestión da dor.No proceso de desgranulación plaquetaria, as plaquetas activadas segregan un gran número de 5-HT derivado das plaquetas, que poden promover a contracción vascular e estimular a activación de plaquetas e linfocitos adxacentes mediante a expresión de 5-HTR en células endoteliais, células musculares lisas e células inmunes.Pacala et al.Estudou o efecto mitótico da 5-HT sobre as células endoteliais vasculares e determinouse o potencial de promover o crecemento dos vasos sanguíneos danados estimulando a anxioxénese.Como se regulan estes procesos non está completamente claro, pero pode implicar vías de sinal bidireccionais diferenciais no microcircuíto do tecido para regular as funcións das células endoteliais vasculares e das células musculares lisas, fibroblastos e células inmunitarias a través de receptores específicos de 5-HT destas células. .Describiuse a función autocrina da 5-HT plaquetaria despois da activación plaquetaria [REF].A liberación de 5-HT mellora a activación das plaquetas e o recrutamento de plaquetas circulantes, levando á activación de reaccións en cascada de sinais e efectores augas arriba que soportan a reactividade plaquetaria.
Efecto inmunomodulador 5-HT
Cada vez hai máis evidencias que mostran que a serotonina pode desempeñar un papel en diferentes 5HTR como modulador inmunolóxico.Segundo o 5HTR expresado en varios leucocitos implicados na reacción inflamatoria, o 5-HT derivado das plaquetas actúa como un regulador inmunitario tanto no sistema inmunitario innato como no adaptativo.O 5-HT pode estimular a proliferación de Treg e regular as funcións das células B, as células asasinas naturais e os neutrófilos mediante o recrutamento de DC e monocitos para o sitio inflamatorio.Estudos recentes demostraron que a 5-HT derivada das plaquetas pode regular a función das células inmunes en condicións específicas.Polo tanto, usando C-PRP, a concentración de plaquetas é superior a 1 × 10 6/µ L pode axudar significativamente a transportar a concentración de 5-HT derivada das plaquetas grandes ao tecido.No microambiente caracterizado por compoñentes inflamatorios, o PRP pode interactuar con varias células inmunes que desempeñan un papel fundamental nestas patoloxías, o que pode afectar aos resultados clínicos.
Figura que mostra a resposta multifacética 5-HT despois da activación das plaquetas inflamatorias de PRP.Despois da activación das plaquetas, as plaquetas liberan os seus gránulos, incluíndo 5-HT en gránulos densos, que ten unha ampla gama de efectos diferenciais sobre varias células inmunitarias, células endoteliais e células do músculo liso.Abreviaturas: SMC: células musculares lisas, EC: células endoteliais, Treg: linfocitos T convencionais, M Φ: Macrófagos, DC: células dendríticas, IL: interleucina, IFN-γ: interferón γ。 Modificado e adaptado de Everts et al.e Hull et al.
Efecto analxésico do PRP
As plaquetas activadas liberarán moitos mediadores proinflamatorios e antiinflamatorios, que non só poden causar dor, senón que tamén reducen a inflamación e a dor.Unha vez aplicada, a dinámica plaquetaria típica do PRP cambia o microambiente antes da reparación e rexeneración dos tecidos a través dunha variedade de vías complexas relacionadas co anabolismo e o catabolismo, a proliferación celular, a diferenciación e a regulación das células nai.Estas características do PRP levan á aplicación do PRP en varias condicións clínicas patolóxicas normalmente asociadas á dor crónica (como lesións deportivas, enfermidades ortopédicas, enfermidades da columna vertebral e feridas crónicas complexas), aínda que o mecanismo exacto non se determinou completamente.
En 2008, Evertz et al.É o primeiro ensaio controlado aleatorizado que informa do efecto analxésico da preparación de PRP, que se prepara a partir da capa marrón da taxa de sedimentación de eritrocitos autólogas e que se activa con trombina autóloga despois da cirurxía do ombreiro.Observaron unha redución significativa nas puntuacións da escala analóxica visual, o uso de analxésicos baseados en opioides e unha rehabilitación postoperatoria máis exitosa.Cabe destacar que reflicten o efecto analxésico das plaquetas activadas e especulan sobre o mecanismo das plaquetas que liberan 5-HT.En resumo, as plaquetas están latentes en PRP recén preparado.Despois da activación das plaquetas directa ou indirectamente (factor tisular), as plaquetas cambian de forma e producen o suficientemente falsa como para favorecer a agregación plaquetaria.Despois, liberan partículas α- e densas intracelulares.O tecido tratado con PRP activado será invadido por PGF, citocinas e outros lisosomas plaquetarios.Máis concretamente, cando as partículas densas liberan o seu contido, liberarán unha gran cantidade de 5-HT que regula a dor.No C-PRP, a concentración de plaquetas é de 5 a 7 veces maior que a do sangue periférico.Polo tanto, a liberación de 5-HT das plaquetas é astronómica.Curiosamente, Sprott et al.O informe observou que a dor aliviouse significativamente despois da acupuntura e a moxibustión, a concentración de 5-HT derivado das plaquetas reduciuse significativamente e, a continuación, aumentou o nivel plasmático de 5-HT.
No periférico, as plaquetas, os mastocitos e as células endoteliais liberarán 5-HT endóxeno durante a lesión do tecido ou trauma cirúrxico.Curiosamente, detectáronse unha variedade de receptores 5-HT de neuronas na área periférica, o que confirmou que a 5-HT pode interferir coa transmisión nociceptiva na área periférica.Estes estudos mostran que a 5-HT pode afectar a transmisión nociceptiva dos tecidos periféricos a través dos receptores 5-HT1, 5-HT2, 5-HT3, 5-HT4 e 5-HT7.
O sistema 5-HT representa un sistema poderoso que pode reducir e aumentar o grao de dor despois da estimulación nociva.A regulación central e periférica dos sinais nociceptivos e os cambios no sistema 5-HT foron informados en pacientes con dor crónica.Nos últimos anos, un gran número de estudos centráronse no papel da 5-HT e os seus respectivos receptores no procesamento e regulación da información nociva, dando lugar a fármacos como os inhibidores selectivos da recaptación de serotonina (ISRS).Este fármaco inhibe a recaptación de serotonina nas neuronas presinápticas despois da liberación de serotonina.Afecta a duración e intensidade da comunicación da serotonina e é un tratamento alternativo para a dor crónica.Necesítase máis investigación clínica para comprender claramente o mecanismo molecular da regulación da dor 5-HT derivada do PRP en enfermidades crónicas e dexenerativas.
Outros datos para resolver o potencial efecto analxésico do PRP pódense obter despois da proba de analxésico modelo animal.As conclusións estatísticas comparativas destes modelos son un reto porque estes estudos conteñen demasiadas variables.Non obstante, algúns estudos clínicos abordaron os efectos nociceptivos e analxésicos do PRP.Varios estudos demostraron que os pacientes que reciben tratamento para a tendinose ou as bágoas do manguito rotador teñen pouco alivio da dor.En cambio, outros estudos demostraron que o PRP pode reducir ou mesmo eliminar a dor dos pacientes con dexeneración dos tendóns, OA, fascite plantar e outras enfermidades do pé e do nocello.Identificáronse a concentración final de plaquetas e a composición celular biolóxica como as principais características do PRP, que axudan a observar o efecto analxésico consistente despois da aplicación do PRP.Outras variables inclúen o método de entrega de PRP, a tecnoloxía de aplicación, o protocolo de activación das plaquetas, o nivel de actividade biolóxica do PGF e as citocinas liberadas, o tipo de tecido de aplicación de PRP e o tipo de lesión.
Cabe destacar que Kuffler resolveu o potencial do PRP para aliviar a dor en pacientes con dor neuropática crónica de leve a severa, secundaria ao nervio non regenerativo danado.O propósito deste estudo é investigar se a dor neuropática pode reducirse ou diminuír debido a que o PRP promove a rexeneración axonal e a reinervación do nervio obxectivo.Sorprendentemente, entre os pacientes que reciben tratamento, a dor neuropática aínda está eliminada ou aliviada polo menos seis anos despois da cirurxía.Ademais, todos os pacientes comezaron a aliviar a dor nas tres semanas despois da aplicación de PRP.
Recentemente, observáronse efectos analxésicos similares de PRP no campo do coidado da pel e da ferida postoperatoria.Curiosamente, os autores informaron dos aspectos fisiolóxicos da dor da ferida asociada á lesión vascular e á hipoxia do tecido cutáneo.Tamén discutiron a importancia da anxioxénese na optimización da osixenación e a entrega de nutrientes.O seu estudo mostrou que, en comparación co grupo control, os pacientes que recibían tratamento con PRP tiñan menos dor e aumentaron significativamente a anxioxénese.Finalmente, Johal e os seus colegas realizaron unha revisión sistemática e unha metaanálise e concluíron que o PRP pode reducir a dor despois de usar PRP en indicacións ortopédicas, especialmente en pacientes que reciben epicondilite externa e OA de xeonllo.Desafortunadamente, este estudo non especificou os efectos dos glóbulos brancos, a concentración de plaquetas ou o uso de activadores plaquetarios esóxenos, porque estas variables afectarían a eficacia global do PRP.Non está clara a concentración de plaquetas de PRP óptima para o máximo alivio da dor.No modelo de rata de tendinose, a concentración de plaquetas foi de 1,0 × 10 6 / μ En L, a dor pódese aliviar completamente, mentres que o alivio da dor causado polo PRP coa metade da concentración de plaquetas redúcese significativamente.Polo tanto, animamos a realizar máis estudos clínicos para investigar os efectos analxésicos de diferentes preparados de PRP.
PRP e efecto anxioxénese
Os preparados de C-PRP na medicina rexenerativa precisa permiten a entrega de biomoléculas liberadas por altas concentracións de plaquetas activadas nos tecidos diana.Polo tanto, iniciáronse unha variedade de reaccións en cascada, que contribúen á regulación inmune no lugar, ao proceso inflamatorio e á anxioxénese para promover a curación e a reparación dos tecidos.
A anxioxénese é un proceso dinámico de varios pasos que implica a xerminación e os microvasos de tecidos de vasos sanguíneos preexistentes.A anxioxénese progresou debido a unha variedade de mecanismos biolóxicos, incluíndo a migración, proliferación, diferenciación e división das células endoteliais.Estes procesos celulares son requisitos previos para a formación de novos vasos sanguíneos.Son esenciais para o crecemento dos vasos sanguíneos preexistentes para restaurar o fluxo sanguíneo e apoiar a alta actividade metabólica da reparación e rexeneración dos tecidos.Estes novos vasos sanguíneos permiten a entrega de osíxeno e nutrientes e a eliminación de subprodutos dos tecidos tratados.
A actividade da anxioxénese está regulada pola estimulación do factor anxioxénico VEGF e dos factores antianxioxénicos (por exemplo, anxiostatina e trombospondina-1 [TSP-1]).No microambiente enfermo e degradado (incluíndo baixa tensión de osíxeno, pH baixo e alto nivel de ácido láctico), os factores anxioxénicos locais restaurarán a actividade da anxioxénese.
Varios medios solubles en plaquetas, como o FGF básico e o TGF-β e o VEGF poden estimular as células endoteliais para producir novos vasos sanguíneos.Landsdown e Fortier informaron de varios resultados relacionados coa composición do PRP, incluíndo as fontes intraplaquetarias de moitos reguladores anxioxénicos.Ademais, concluíron que o aumento da anxioxénese contribúe á curación da enfermidade MSK en áreas con mala vascularización, como a rotura do menisco, a lesión dos tendóns e outras áreas con mala vascularización.
Propiedades promotoras e antiangioxénicas das plaquetas
Nas últimas décadas, estudos publicados demostraron que as plaquetas xogan un papel fundamental na hemostase primaria, formación de coágulos, factor de crecemento e liberación de citocinas e regulación da anxioxénese como parte do proceso de reparación do tecido.Paradoxalmente, PRP α- Os gránulos conteñen un arsenal de factores de crecemento pro-anxioxénicos, proteínas anti-anxioxénicas e citocinas (como PF4, inhibidor do activador do plasminóxeno-1 e TSP-1), e teñen como obxectivo a liberación de factores específicos que desempeñan un papel. .Papel na anxioxénese.Polo tanto, o papel do PRP no control da regulación da anxioxénese pode definirse pola activación de receptores específicos da superficie celular, o TGF-β. Inicia reaccións pro-anxioxénicas e anti-anxioxénicas.A capacidade das plaquetas para exercer a vía da anxioxénese foi confirmada na anxioxénese patolóxica e na anxioxénese tumoral.
Factor de crecemento anxioxénico derivado das plaquetas e factor de crecemento antianxioxénico, derivado de moléculas α- E densas e adhesivas.O máis importante é que acéptase xeralmente que o efecto global das plaquetas sobre a anxioxénese é proanxioxénico e estimulante.Espérase que a terapia con PRP controle a indución da anxioxénese, o que contribuirá ao efecto do tratamento de moitas enfermidades, como a cicatrización de feridas e a reparación de tecidos.A administración de PRP, máis concretamente a administración de PGF de alta concentración e outras citocinas plaquetarias, pode inducir anxioxénese, anxioxénese e arterioxénese, porque o factor 1a derivado das células do estroma únese ao receptor CXCR4 das células proxenitoras endoteliais.Bill et al.Suxírese que o PRP aumenta a neovascularización isquémica, que pode deberse á estimulación da anxioxénese, anxioxénese e arterioxénese.No seu modelo in vitro, a proliferación de células endoteliais e a formación de capilares foron inducidas por un gran número de PDG diferentes, dos cales o VEGF foi o principal estimulador anxioxénico.Outro factor importante e esencial para restaurar a vía da anxioxénese é a sinerxía entre múltiples PGF.Richardson et al.Probouse que a actividade sinérxica do factor anxioxénico do factor de crecemento derivado das plaquetas-bb (PDGF-BB) e do VEGF levou á formación rápida de rede vascular madura en comparación coa actividade do factor de crecemento individual.O efecto combinado destes factores confirmouse recentemente nun estudo sobre a mellora da circulación colateral cerebral en ratos con hipoperfusión a longo prazo.
O máis importante é que un estudo in vitro mediu o efecto proliferativo das células endoteliais da vea umbilical humana e varias concentracións de plaquetas na selección do dispositivo de preparación de PRP e da estratexia de dose de plaquetas, e os resultados mostraron que a dose óptima de plaquetas era de 1,5 × 10 6 plaquetas/μ. 50. Promover a anxioxénese.A concentración de plaquetas demasiado alta pode inhibir o proceso de anxioxénese, polo que o efecto é pobre.
Envellecemento celular, envellecemento e PRP
A senescencia celular pode ser inducida por varios estímulos.Este é un proceso no que as células deixan de dividirse e sofren cambios fenotípicos únicos para evitar o crecemento sen restricións das células danadas, o que xoga un papel importante na prevención do cancro.No proceso de envellecemento fisiolóxico, o envellecemento da replicación celular tamén promoverá o envellecemento celular e reducirase a capacidade de rexeneración das MSC.
Efectos do envellecemento e do envellecemento celular
In vivo, moitos tipos de células envellecen e acumúlanse en varios tecidos durante o envellecemento, entre os que hai un gran número de células envellecidas.A acumulación de células envellecidas parece aumentar co aumento da idade, danos ao sistema inmunitario, danos nos tecidos ou factores relacionados co estrés.O mecanismo do envellecemento celular identificouse como o factor patóxeno de enfermidades relacionadas coa idade, como a artrose, a osteoporose e a dexeneración do disco intervertebral.Unha variedade de estímulos agravará o envellecemento celular.En resposta, o fenotipo secretor relacionado coa senescencia (SASP) segregará altas concentracións de células proteicas e citocinas.Este fenotipo especial está relacionado coas células envellecidas, nas que segregan altos niveis de citocinas inflamatorias (como IL-1, IL-6, IL-8), factores de crecemento (como TGF-β、 HGF, VEGF, PDGF), MMP e catepsina.En comparación cos mozos, comprobouse que SAPS aumenta coa idade, porque o proceso de estado estacionario destrúese, o que provoca o envellecemento celular e a capacidade de rexeneración reducida.En concreto, en enfermidades articulares e enfermidades do músculo esquelético.Neste sentido, o envellecemento inmunitario considérase un cambio significativo no espectro de secreción das células inmunitarias, o que indica que a concentración de TNF-a, IL-6 e/ou Il-1b aumenta, o que leva a unha inflamación crónica de baixo grao.Cabe destacar que a disfunción das células nai tamén está relacionada con mecanismos autónomos non celulares, como as células do envellecemento, especialmente a produción de factores proinflamatorios e antirrexenerativos a través de SASP.
Pola contra, SASP tamén pode estimular a plasticidade celular e a reprogramación das células adxacentes.Ademais, SASP pode organizar a comunicación con varios mediadores inmunes e activar as células inmunitarias para promover a eliminación das células do envellecemento.Comprender o papel e a función das células envellecidas contribuirá á curación e á remodelación dos tecidos dos músculos MSK e das feridas crónicas.
É de destacar que Ritcka et al.Realizouse un amplo estudo e descubriuse o papel principal e beneficioso do SASP na promoción da plasticidade celular e a rexeneración de tecidos e introduciuse o concepto de tratamento transitorio das células envellecidas.Mencionaron con cautela que o envellecemento é principalmente un proceso beneficioso e rexenerativo.
Envellecemento celular e potencial do PRP
A medida que diminúe o número de células nai, o envellecemento afectará o rendemento das células nai.Do mesmo xeito, nos humanos, as características das células nai (como a sequedade, a proliferación e a diferenciación) tamén diminúen coa idade.Wang e Nirmala informaron de que o envellecemento reduciría as características das células nai das células do tendón e o número de receptores do factor de crecemento.Un estudo en animais mostrou que a concentración de PDGF en cabalos novos era alta.Concluíron que o aumento do número de receptores GF e do número de GF en individuos novos pode ter unha mellor resposta celular ao tratamento con PRP que os individuos maiores en individuos novos.Estes achados revelan por que o tratamento con PRP pode ser menos efectivo ou mesmo ineficaz en pacientes anciáns con menos células nai e "mala calidade".Probouse que o proceso de envellecemento da cartilaxe de envellecemento inverte e que o período de repouso dos condrocitos aumenta despois da inxección de PRP.Jia et al.Úsase para estudar o fotoenvellecemento in vitro de fibroblastos dérmicos de rato, con e sen tratamento con PRP, para aclarar o mecanismo de contrarrestamento do PGF neste modelo.O grupo PRP mostrou un efecto directo sobre a matriz extracelular, aumentou o coláxeno tipo I e diminuíu a síntese de metaloproteinases, o que indica que o PRP pode contrarrestar o envellecemento celular e tamén na enfermidade dexenerativa de MSK.
Noutro estudo, o PRP utilizouse para recoller células nai de medula ósea envellecidas de ratos anciáns.Determinouse que o PRP pode recuperar unha variedade de funcións das células nai do envellecemento, como a proliferación celular e a formación de colonias, e reconstruír os marcadores relacionados co envellecemento celular.
Recentemente, Oberlohr e os seus colegas estudaron amplamente o papel do envellecemento celular no debilitamento da rexeneración muscular e avaliaron o PRP e o plasma pobre en plaquetas (PPP) como opcións de tratamento biolóxico para a reparación do músculo esquelético.Eles imaxinaron que o tratamento con PRP ou PPP para a reparación do músculo esquelético basearíase en factores biolóxicos personalizados para marcadores celulares específicos de SASP e outros factores que conducen ao desenvolvemento da fibrose.
É razoable crer que antes da aplicación do PRP, o envellecemento celular dirixido pode mellorar as características de rexeneración da eficacia do tratamento biolóxico ao reducir os factores SASP locais.Suxeriuse que outra opción para mellorar os resultados do tratamento con PRP e PPP para a rexeneración do músculo esquelético é eliminar selectivamente as células envellecidas con eliminadores do envellecemento.Non hai dúbida de que os resultados recentes da investigación sobre o efecto do PRP no envellecemento celular e o envellecemento son fascinantes, pero aínda están na fase inicial.Polo tanto, non é razoable facer ningunha suxestión neste momento.
(Os contidos deste artigo son reimpresos e non ofrecemos ningunha garantía expresa ou implícita sobre a exactitude, fiabilidade ou integridade dos contidos deste artigo, e non somos responsables das opinións deste artigo, por favor entendelo.)
Hora de publicación: 01-mar-2023